【マンガ】分極/極性/電気陰性度とは?わかりやすく説明!(基礎化学)
化学で出てくる「電気陰性度」「極性」「分極」ってどうもわかりにくいですよね。
ということで今回も化学が苦手な人のためのマンガを描いてみました!
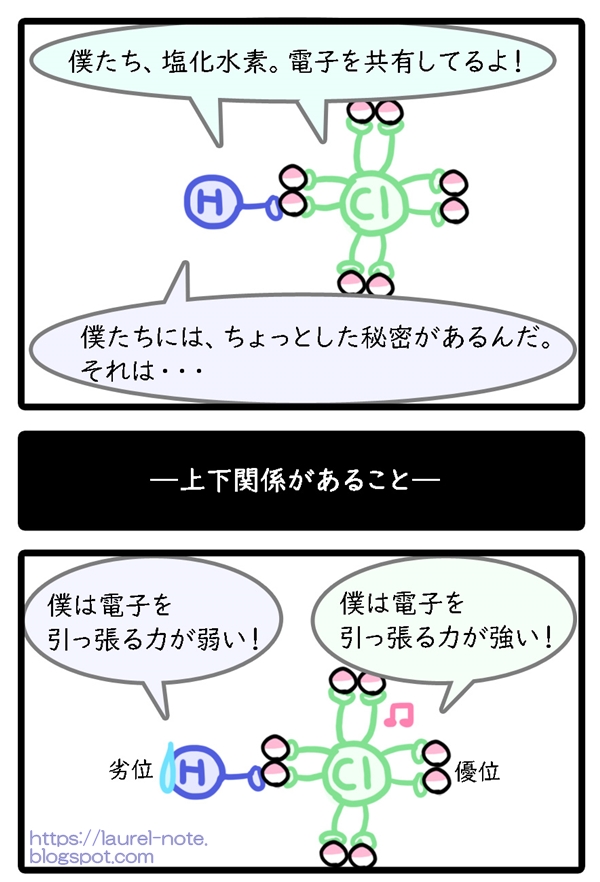
「共有結合」により物質が結合したら、電子を共有するわけですが、引っ張る力が強いほうに電子は引っ張られます。
電子が引っ張られると、引っ張る力が弱い原子からは電子が遠ざかります。
すると力が弱い方は、電子を失ったような感じになります。
水素が電子を失うと、+が付きます。
塩素は、力が強いため電子を引き寄せ、自分の物のようにします。
塩素が電子を手に入れると-が付きます。
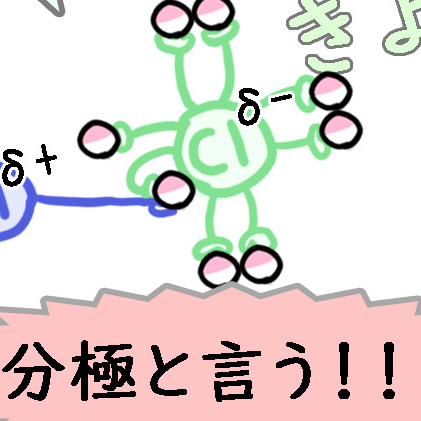
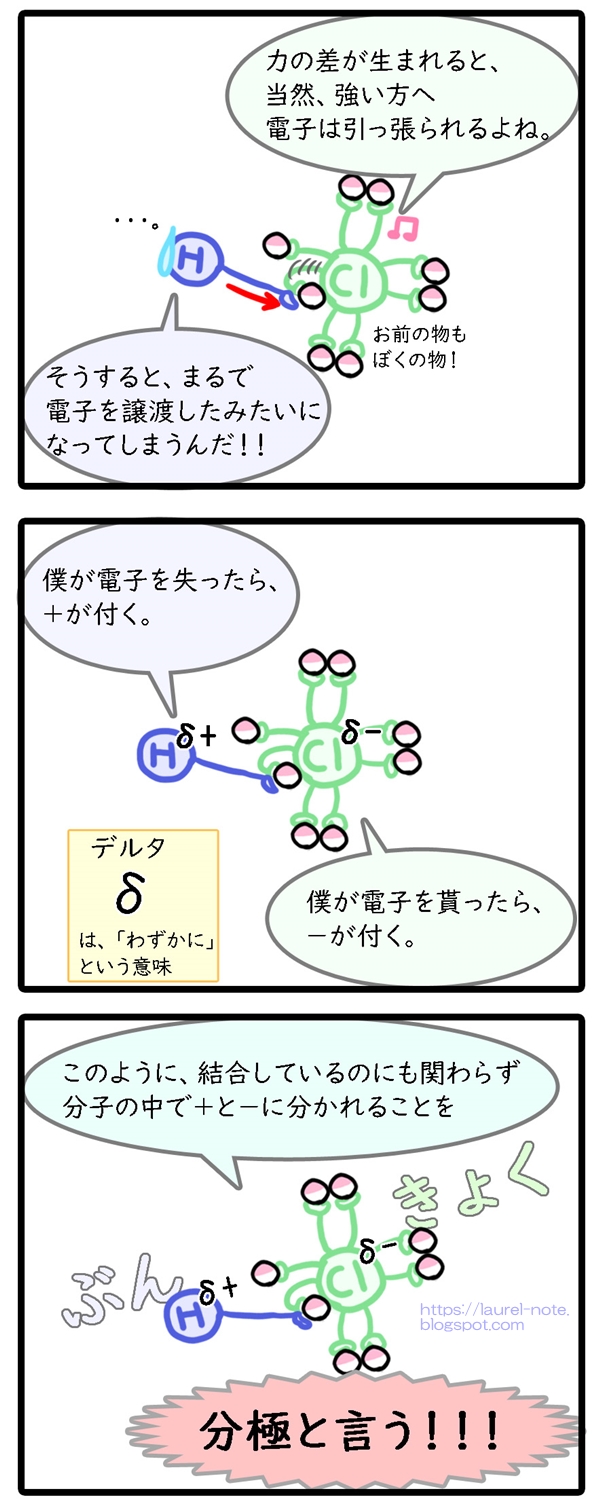
このように、電子を引っ張る力によって電子がどちらかに偏り、それにより電子を失った、または獲得してた状態になることを分極と言います。
分子が+極と-極に分かれたので、名前の通りですね。
物質が分極してどこかに電子が偏り、弱い+、弱い-が付く時、「δ(デルタ)」を書きます。「δ」は主に、「とても小さい」という意味を表す時に使われます。
また、電子が分極する性質のことを「極性」と言います。
そして極性のある分子の事を「極性分子」と言います。
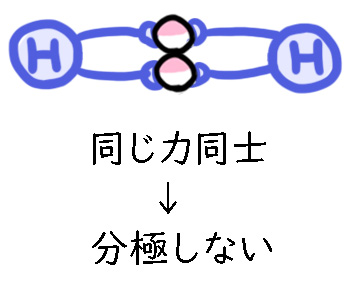
引っ張る力が同じ者同士の結合であれば、電子が偏らないので分極しません。
極性がない分子のことを「無極性分子」と言います。
・二酸化炭素
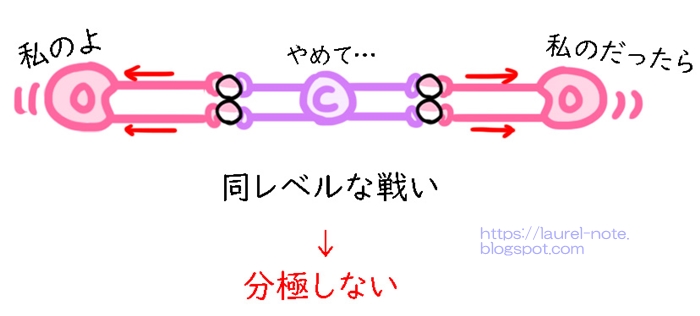
二酸化炭素は、Cが真ん中にいて、両脇にOが直線状に二重結合している状態になります。
電子を引っ張る力は、Oの方が強いです。
つまり、両脇にいる同じ腕力のOによって、Cが水平に、外側に引っ張られている状態になるので、うまくバランスがとれ、分極しません。
・メタン
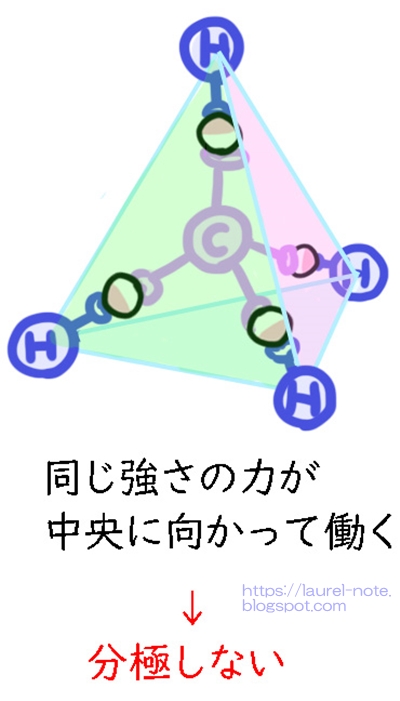
メタンは、Cが真ん中にいて正四面体の角にHがくっついている状態になっています。
電子を引っ張る力はCの方が強いので、Hの電子が内側に引っ張られることになります。
正四面体の角は、どこのポジションにいても、まん中までの距離が同じになり、電子もそれ以上動きようがなくなるのでバランスがとれ、分極しない、というわけです。
電子を引っ張る力のことを、電気陰性度(でんきいんせいど)と言います。
「電子陰性度」ではないので注意。
この数値によって、力がどれくらいなのか判断できます。
元素の周期表の、右上に行けば行くほど持っている力が強くなります。(※希ガスを省く)
詳しい数値は→【電気陰性度(wikipedia)】
特にテストで出題されるのは、
F、O、Cl、N、Hです。
「電気陰性度が高いの、低いのはどれか?」ってな具合です。
【電気陰性度(wikipedia)】によると、F:3.98、O:3.44、Cl:3.16、N:3.04、H:2.20
ですが、これらは高校では小数第2位で四捨五入されるため
F:4.0、O:3.4、Cl:3.2、N:3.0、H:2.2
もしくは
F:4.0、O:3.4、Cl:3.0、N:3.0、H:2.2
と説明されます。
先生によって
A「NとClの電気陰性度は同じ」
B「NよりもClの方が電気陰性度が高い」
と、言ってることが違ってくるので、混乱しないようにしましょう。
「化学基礎」レベルであれば、「FとOが高くてHが低い」ことを覚えてしまえばバッチリだと思います!
関連記事はコチラ
➜ サイトのもくじ【化学】
ということで今回も化学が苦手な人のためのマンガを描いてみました!
🔶分極とは?



分極とは?
「共有結合」により物質が結合したら、電子を共有するわけですが、引っ張る力が強いほうに電子は引っ張られます。
電子が引っ張られると、引っ張る力が弱い原子からは電子が遠ざかります。
すると力が弱い方は、電子を失ったような感じになります。
水素が電子を失うと、+が付きます。
塩素は、力が強いため電子を引き寄せ、自分の物のようにします。
塩素が電子を手に入れると-が付きます。
このように、電子を引っ張る力によって電子がどちらかに偏り、それにより電子を失った、または獲得してた状態になることを分極と言います。
分子が+極と-極に分かれたので、名前の通りですね。
物質が分極してどこかに電子が偏り、弱い+、弱い-が付く時、「δ(デルタ)」を書きます。「δ」は主に、「とても小さい」という意味を表す時に使われます。
また、電子が分極する性質のことを「極性」と言います。
そして極性のある分子の事を「極性分子」と言います。
極性分子の代表
塩化水素(HCl)、水(H2O)、アンモニア(NH3)無極性分子

引っ張る力が同じ者同士の結合であれば、電子が偏らないので分極しません。
極性がない分子のことを「無極性分子」と言います。
無極性分子の代表
水素(H2)、塩素(Cl2)、二酸化炭素(CO2)、メタン(CH4)◆なんで二酸化炭素とメタンも無極性分子なの?
・二酸化炭素

二酸化炭素は、Cが真ん中にいて、両脇にOが直線状に二重結合している状態になります。
電子を引っ張る力は、Oの方が強いです。
つまり、両脇にいる同じ腕力のOによって、Cが水平に、外側に引っ張られている状態になるので、うまくバランスがとれ、分極しません。
・メタン

メタンは、Cが真ん中にいて正四面体の角にHがくっついている状態になっています。
電子を引っ張る力はCの方が強いので、Hの電子が内側に引っ張られることになります。
正四面体の角は、どこのポジションにいても、まん中までの距離が同じになり、電子もそれ以上動きようがなくなるのでバランスがとれ、分極しない、というわけです。
力が強い、弱いはどうやったらわかるの?
電子を引っ張る力のことを、電気陰性度(でんきいんせいど)と言います。
「電子陰性度」ではないので注意。
この数値によって、力がどれくらいなのか判断できます。
元素の周期表の、右上に行けば行くほど持っている力が強くなります。(※希ガスを省く)
詳しい数値は→【電気陰性度(wikipedia)】
特にテストで出題されるのは、
F、O、Cl、N、Hです。
「電気陰性度が高いの、低いのはどれか?」ってな具合です。
【電気陰性度(wikipedia)】によると、F:3.98、O:3.44、Cl:3.16、N:3.04、H:2.20
ですが、これらは高校では小数第2位で四捨五入されるため
F:4.0、O:3.4、Cl:3.2、N:3.0、H:2.2
もしくは
F:4.0、O:3.4、Cl:3.0、N:3.0、H:2.2
と説明されます。
先生によって
A「NとClの電気陰性度は同じ」
B「NよりもClの方が電気陰性度が高い」
と、言ってることが違ってくるので、混乱しないようにしましょう。
「化学基礎」レベルであれば、「FとOが高くてHが低い」ことを覚えてしまえばバッチリだと思います!
関連記事はコチラ
➜ サイトのもくじ【化学】

