3種類のファンデルワールス力って何?ネット上でも意見が割れてるのでわかりやすくまとめてみた
「ワンデルワールス力」と聞いて私が思い浮かんだこと、それは
「動く電子が偏った時に起こる弱い結合」
でした。
でも、厳密にはちょっと違うんですね?
調べて分かりやすくまとめてみることにしました!



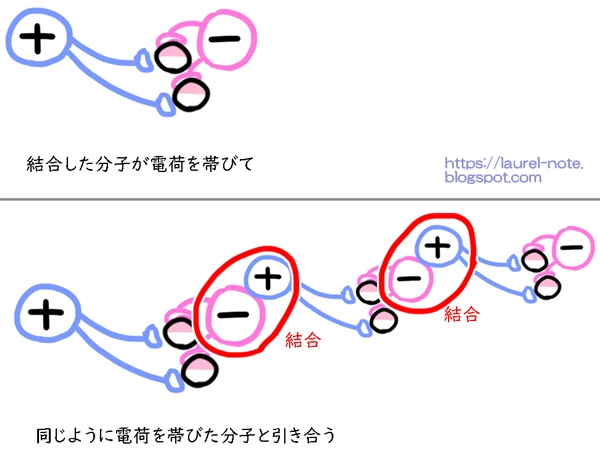
分子の中で+と-で分かれている「極性分子」は、別の「極性分子」と電荷の力によってくっつくことがあります。
また、逆に同じ電荷が隣り合うと離れることもあります。
このことを、配向力(配向効果)と言います。
【くっつく物】
極性分子ー極性分子
→【水素結合って?】
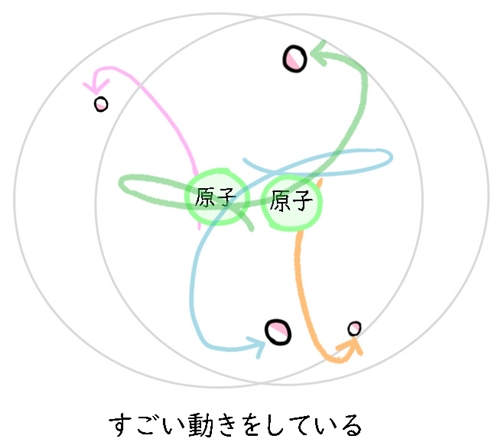
しかも、全部の電子が綺麗な縁を描いているのではなく、結構めちゃくちゃな動きをしています。
めちゃくちゃな動きをしていると、電子がどこかに偏る瞬間が出てきます。
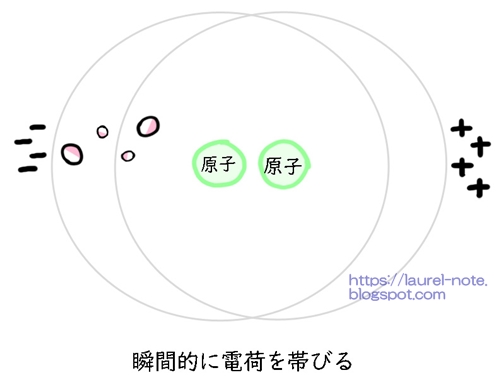
すると、電子が偏った方に-の電荷、電子がなくなった方に+の電荷が帯びます。
電荷が帯びたら、それに対応する分子が引き寄せられます。
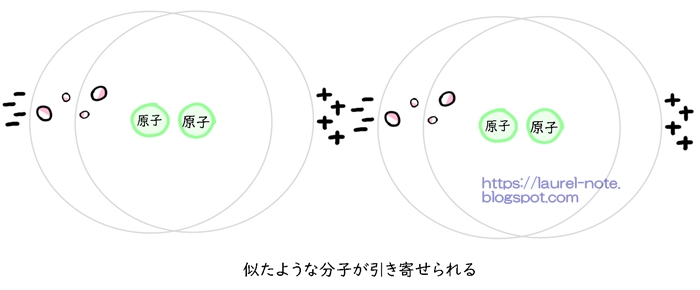
この引き寄せられる力を、分散力(分散効果)と言います。
結合しても電荷は動き回るのをやめないので、結合する力は弱まったり強まったりします。
分子が大きいほど、その分電子が固まって強い電荷を帯びることがあるので、「ファンデルワールス力が大きい」と言えます。
ちなみに「ロンドン」は定義した人の名前です。
【くっつく物】
無極性分子ー無極性分子
◆電子の動き
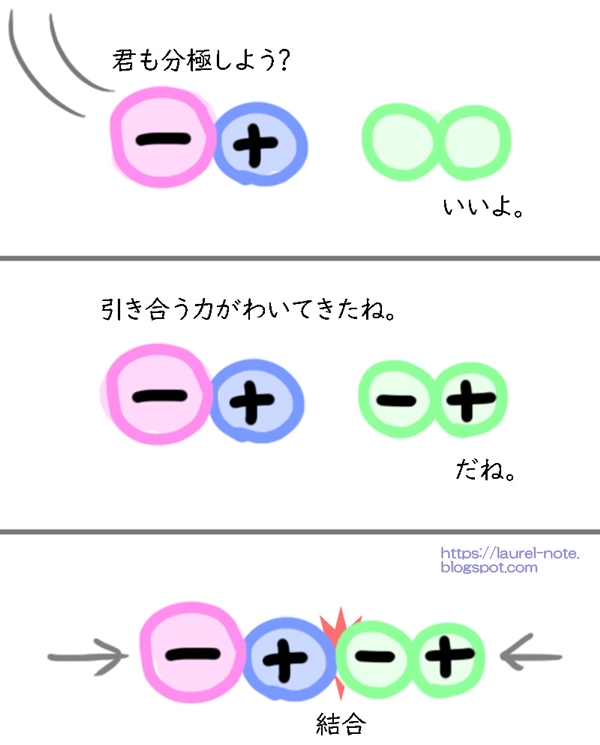
「極性分子」が、電荷が分かれていない「無極性分子」に近づくことにより、「極性分子」の影響を受けて「無極性分子」まで分極し、引き合う力を、誘起力(誘起効果)と言います。
【くっつく物】
極性分子―無極性分子
すべて、あらゆる分子の間で働きます。
ただし、ファンデルワールス力よりも強い引力(イオン結合など)があれば、そちらが優先されるので、ファンデルワールス力は無視されることになります。
ファンデルワールス力よって起こる結合をファンデルワールス結合と言います。
・ファンデルワールス力は、配向力、誘起力、分散力の3種類ある。(教科書で説明される時はこの並び順)
・配向力は、水素結合のような力。極性分子同士が帯びた電荷によってくっつく。
・誘起力は、極性分子の影響で無極性分子が分極してくっつく力。
・分散力は、動く電子が偏った時に電荷を帯びてそれによってくっつく力。
・ファンデルワールス力(Wikipedia)
・ロンドン分散力(Wikipedia)
・Ⅰ.分子間力と相互作用の基礎(分子進化情報学研究室/武藤吉徳 Web Page)
・分子間力ー分子間相互作用の本質(愛媛大学工学部応用有機学科/構造有機化学研究室)
関連記事はコチラ
➜ サイトのもくじ【化学】
「動く電子が偏った時に起こる弱い結合」
でした。
でも、厳密にはちょっと違うんですね?
調べて分かりやすくまとめてみることにしました!
🔶ファンデルワールス力

ファンデルワールス力は3種類ある

行け!ファンデル!
一番簡単「配向力」
配向力は一言で言えば「水素結合の、弱いバージョン」です。水素結合と同じような原理で結合します。
分子の中で+と-で分かれている「極性分子」は、別の「極性分子」と電荷の力によってくっつくことがあります。
また、逆に同じ電荷が隣り合うと離れることもあります。
このことを、配向力(配向効果)と言います。
◆なんでファンデルワールス力と水素結合は区別されているの?
水素結合の方が引力が強いからです。【くっつく物】
極性分子ー極性分子
→【水素結合って?】
一番有名「分散力(ロンドン分散力)」
電子は、原子の回りを動き回っています。
しかも、全部の電子が綺麗な縁を描いているのではなく、結構めちゃくちゃな動きをしています。
めちゃくちゃな動きをしていると、電子がどこかに偏る瞬間が出てきます。

すると、電子が偏った方に-の電荷、電子がなくなった方に+の電荷が帯びます。
電荷が帯びたら、それに対応する分子が引き寄せられます。

この引き寄せられる力を、分散力(分散効果)と言います。
結合しても電荷は動き回るのをやめないので、結合する力は弱まったり強まったりします。
分子が大きいほど、その分電子が固まって強い電荷を帯びることがあるので、「ファンデルワールス力が大きい」と言えます。
ちなみに「ロンドン」は定義した人の名前です。
【くっつく物】
無極性分子ー無極性分子
◆電子の動き
誘ってくっつく「誘起力」

「極性分子」が、電荷が分かれていない「無極性分子」に近づくことにより、「極性分子」の影響を受けて「無極性分子」まで分極し、引き合う力を、誘起力(誘起効果)と言います。
【くっつく物】
極性分子―無極性分子
3つの共通点
すべて、あらゆる分子の間で働きます。
ただし、ファンデルワールス力よりも強い引力(イオン結合など)があれば、そちらが優先されるので、ファンデルワールス力は無視されることになります。
ファンデルワールス結合
ファンデルワールス力よって起こる結合をファンデルワールス結合と言います。
まとめ
・ファンデルワールス力は、配向力、誘起力、分散力の3種類ある。(教科書で説明される時はこの並び順)
・配向力は、水素結合のような力。極性分子同士が帯びた電荷によってくっつく。
・誘起力は、極性分子の影響で無極性分子が分極してくっつく力。
・分散力は、動く電子が偏った時に電荷を帯びてそれによってくっつく力。
参考
・ファンデルワールス力(Wikipedia)
・ロンドン分散力(Wikipedia)
・Ⅰ.分子間力と相互作用の基礎(分子進化情報学研究室/武藤吉徳 Web Page)
・分子間力ー分子間相互作用の本質(愛媛大学工学部応用有機学科/構造有機化学研究室)
関連記事はコチラ
➜ サイトのもくじ【化学】

