【公式いらず】モルとは?わかりやすく説明!化学アレルギーの人必見!
「モル」って聞いただけで寒気がする人いらっしゃい!
あえて「ダースの例え」を使わずに他のものに例えて説明します!😄
公式なしでも必ず理解できる!!
モルとは簡単に言うと、「物質の単位」です!
具体的には、6.02×1023個を1セットとした粒子の集まりのことを言います。(詳しい数字については後述します)


今、オリジナルの単位を一つ思いつきました💡
その単位を「モリ」とします。
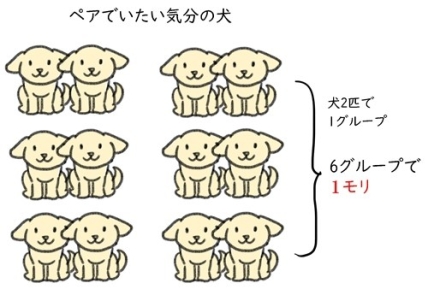
そして、動物6組を1セットで「1モリ」とします。
例えば…
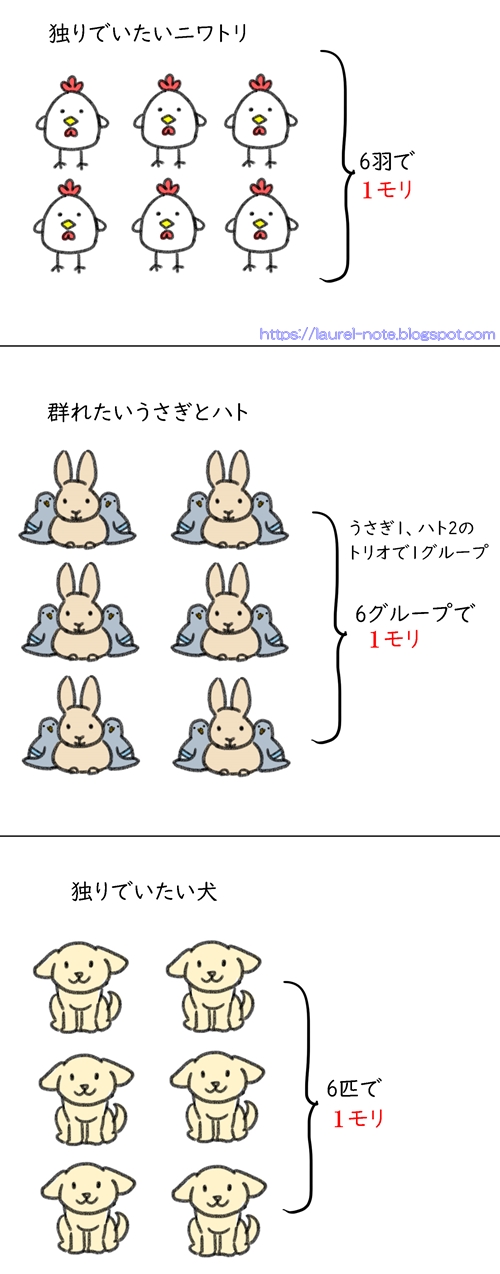
単独でいたい(他人とくっついていたくない)動物は、6匹で1モリとします。
群れたい(他人とくっついていたい)動物は、6グループで1モリとします。
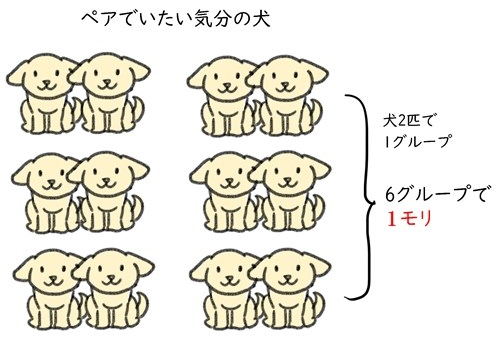
同じ動物でも、単独でいたい時と群れたい時があります。
群れたい場合は、くっついた状態で1グループとなり、それが6グループで1モリとなります。
ここで一番重要となるのは、「×6」で「1モリ」としている点です。
ではクイズです🌟
Q. 体重2kgのニワトリが1モリいると何kgになりますか?
(答えは下にあります)
答え. 12kg。
解説)2kg×6羽なので。
Q. 体重2.6kgのうさぎと、体重0.2kgの鳩2羽の仲良しグループが1モリいると、全体で何kgになりますか?
※ヒント:うさぎ2.6kg+鳩0.2kg+鳩0.2kg=3.0kg→それが1モリいると?
答え. 18kg。
解説)うさぎと鳩のグループ3.0kg×6組となって18kg。
わからない時は紙にイラストを書いてみると理解できますよ😊
Q. 単独行動が好きな犬がたくさんいます。犬全体の重さをまとめて計ったところ、48kgありました。犬は何モリいますか?※犬は1匹4kgとする。
※ヒント:まず犬の数を出す。48kg÷4kg=12匹。→つまり何モリ?
答え. 2モリ。
解説)6で割ります。12匹÷6=2モリ
Q. 2匹で1組になりたい犬がたくさんいます。犬全体の重さをまとめて計ったところ、48kgありました。ペアの犬は何モリいますか?※犬は1匹4kgとする。
※ヒント:まず犬の数を出す。48kg÷4kg=12匹。今回はペアの犬なので…?
答え. 1モリ。
解説)2匹で1組なので、それが6つ=12匹で1モリ。
どうでしたでしょう?意外と単純な計算ではないでしょうか?
「モル」も同じような考え方になります!
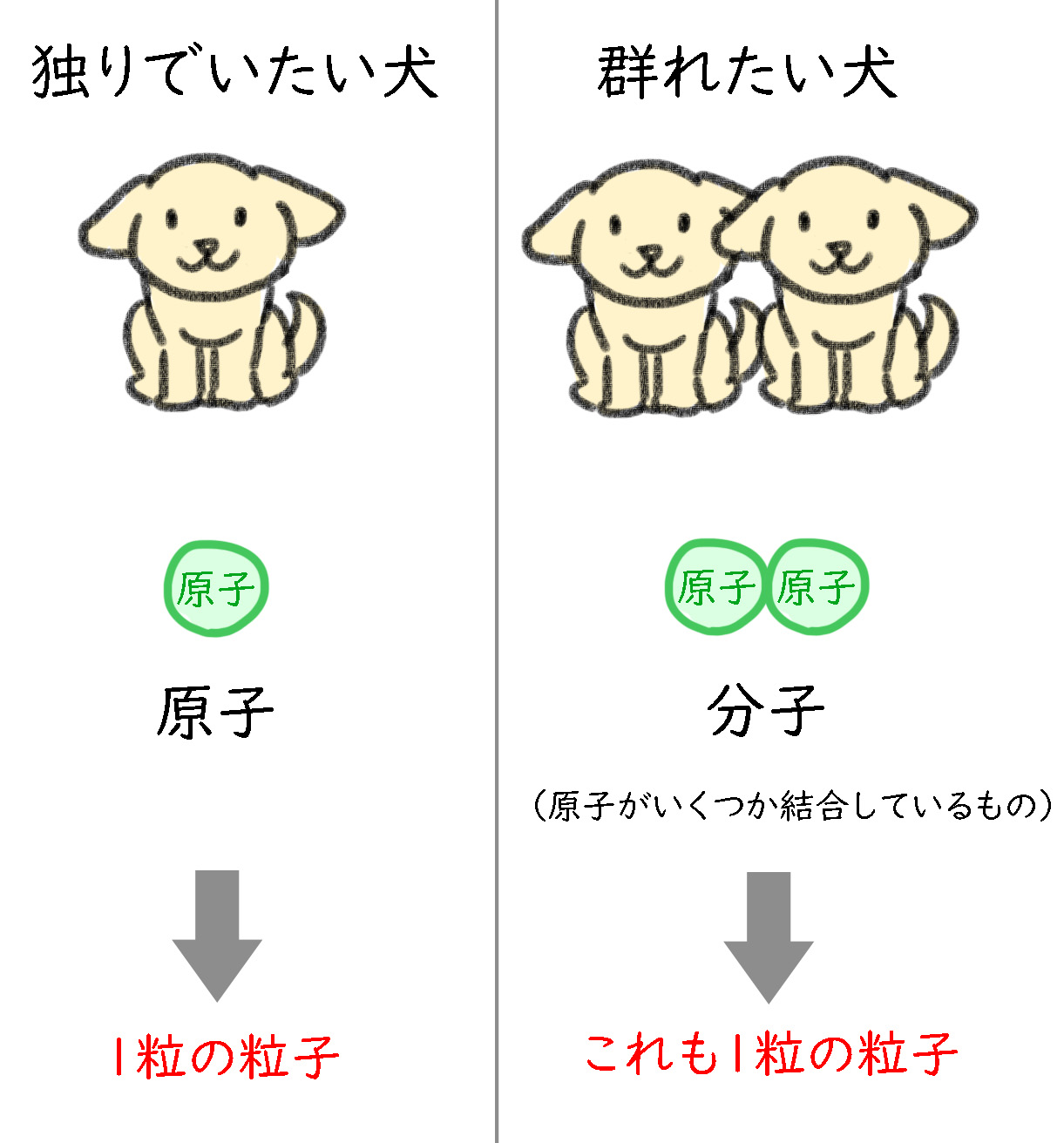
上の説明で動物としていたものを「粒子」として考えます。
◆単独行動をしたい子は原子の粒
◆誰かと一緒にいないと落ち着かない子を分子の粒とします。
「原子」として単独行動する場合にもモルは使われますが、
「分子」として群れた状態でも「1粒の粒子」としてモルを使っていきます。
※「イオン結合」や「金属結合」では「分子」は出来ないものの、原子同士が結合して粒を形成しています。この場合も「1粒の粒子」としてモルを使っていきます。

考え方は動物のモリと一緒です。
独りでいたい子は、6つ集まって1モル。
群れたい子達も、それが6つ集まってで1モル。
「1粒の重さ」つまり「質量」は体重のことなので、kgがgになっただけです。
ダイヤモンドのもとである炭素(C)の質量(体重)は、
2.0×10-23gです。
これが1モル(6.02×1023個)あると…
(2.0×10-23)g×(6.02×1023)個 =12.04 g
よって、炭素は1モルあたり12gということになります。
このような、1モル当たりの物質の重さのことを「モル質量」と呼びます。
モル質量は「〇g/mol」というように表します。
なので、炭素のモル質量は12g/molです。

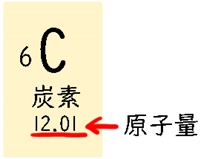
モル質量は、原子量と同じ数になります。
周期表を見るとわかりますが、炭素の原子量は12です。
モル質量12g/molと同じですね。
すでに結合している物の場合は、原子を足した数がモル質量になります。
例えば塩化ナトリウム(NaCl)の場合、
Naの原子量は23、Clの原子量は35.5なので、
モル質量は58.5g/molとなります。
ではクイズです🌟
Q. 酸化アルミニウム(Al2O3)のモル質量を原子量から求める式を答えてください。
アルミニウムの原子量は27、酸素の原子量は16です。
答え. 27+27+16+16+16/もしくは(27×2)+(16×3)
よって酸化アルミニウムのモル質量は「102g/mol」になります。
「1023」「10-23」が出てくるせいで、計算式が難しそうに見えてしまいますよね。
でも理解してしまえば楽勝!
◆「1023」は10の23乗。
「1にゼロが23個つきますよ」という意味です。
つまり、
1023
=100,000,000,000,000,000,000,000
=1000垓(がい)

世界の億万長者の総資産額にも出てこない桁ですね!😲
この数が出てくるタイミングは、「個数」が関係しているときです。
とにかく粒子は細かくてたくさんあるので、こうやって省略しなければやってられないのです。
◆「10-23」は10の-23乗。
「1の前にゼロが23個つきますよ」という意味です。
つまり、
10-23
=0.00000000000000000000001
=1000垓分の1
この数が出てくるタイミングは、「粒子の重さ」が関係しているときです。
とにかく粒子はサイズが小さく軽いので、こうやって省略しなければやってられないのです。
なので、先にあった
(6.02×1023)個 ×(2.0×10-23)g=12.04 g
という計算式の青字の部分は相殺されるので消えてなくなります。
ではクイズです🌟
Q. 質量3.0×10-23gの水分子のモル質量は何gですか?
答え. 18g。
解説)質量3g×6.02個。
もしくは、原子量を知っていれば酸素の原子量16と水素の原子量1×2個を合わせて出してもOK。
Q. では、水10molには、水分子が何個含まれていますか?
答. 6.02×1024個
解説)水1molには水分子は6.02×1023個含まれているので、その10倍。
ゼロが1つ増えるので10の右上に付いている数が1増えます。
たまにこういう問題出ますけど、
もはや化学の問題ではなく数学の問題ですよね。
Q. では、CO2の質量は何gですか?(原子量:C=12、O=16)
ヒント:
①まずCO2のモル質量出します。
原子量=モル質量なので、
12+16+16=44で、44g/molであることがわかります。
②1molあたり44gということなので、CO2の重さは…?
答. 7.3×10-23g
解説)44÷6.02=7.3。→7.3×10-23g
※「23」の前につけるものが「+」なのか「-」なのか分からなくなった時は、イメージを思い出しましょう。
個数が関係してくるときはそれが大量にあるので「+」、粒子の重さが関係してくるときはそれの大きさがあまりにも軽いので「-」が付きます。
モルを理解すれば、公式は必要ないことがわかりましたね。
でも先生によっては公式そのものをテストで聞いてくることもあるみたいなので、テンプレートの公式を貼っておきますね。
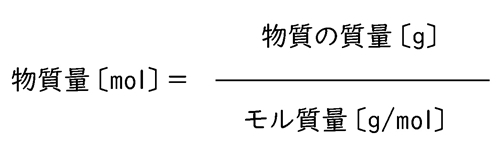
◆物質量〔mol〕:何molあるか?です。モルの数のことを物質量と言います。
◆物質の質量〔g〕:その物質の重さの事です。何モルあったとしても、全~部あわせた合計の重さです。
◆モル質量〔g/mol〕:1モル当たりの重さです。原子の合計の数と同じ数になります。
名前が紛らわしくてイラっと来ますよね。
この公式の存在が学生のモル嫌いを加速させている気がします。
→【まとめ】相対質量,原子量,〇の質量,物質量,モル質量,質量数,分子量,式量の違いをわかりやすく解説!
◆水の物質量を求めたい時
❓mol=18g÷18g/mol
→1になりますね。
◆水の質量を求めたい時
1mol=❓g÷18g/mol
→1=❓/18
→両方に18をかけたら、答えは18になりますね。(この計算がわからない人は公式に触れない方がいいです。)
◆水のモル質量を求めたい時
1mol=18g÷❓
→1=18/❓
→18になりますね。
公式に矛盾がないことが確認できました。
では公式にあてはめてみようクイズです🌟
Q. 水が180gあります。物質量は何molですか?(水の原子量は18)
答. 10mol
解説)❓mol=180g÷18g/mol
Q. 2molのアルミニウムの質量は何gですか?(アルミニウムの原子量は27)
答. 54g
解説)2mol=❓÷27g/mol
※公式に当てはめる手間よりも普通に考えて2mol×27をしてしまった方が早い
Q. 0.5molあたり66.75gの塩化アルミニウムのモル質量は何mol/gですか?
答. 133.5mol/g
解説)0.5mol=66.75g÷❓
1molである「6.02×1023」は何個か?
ここまで見てきたら何となくわかりますね。
1023
=100,000,000,000,000,000,000,000
に
6.02をかけるので、
602,000,000,000,000,000,000,000 。
つまり、6020垓。
ろくせんにじゅうがいです。
ニワトリが6020垓いると考えると、ものすごい数に感じますね。
でも原子や分子はこれだけ集まって、ようやく1モルなのです。
※厳密には、今わかっている時点で6.022140857×1023 個
なんで6.02×1023という中途半端な数字なの?
この数字を考えるにあたって重要なキーワードは、「粒子」と「原子量」です。
粒子は、1粒の物質の事ですね。原子量は、周期表の元素名の下に書いてあるアレです。持っている陽子と中性子を足した数です。
で、不思議なことに、
粒子が一定数集まると、どんな物質でも原子量(または原子が結合した合計)の数と同じ重さになることが学者さんの研究でわかりました。
その粒子の一定数が「6.02×1023」だったのです。この数を導き出した人、すごいです😊
そして、この不思議な数は「アボガドロ定数」(NA)と名付けられることになりました。
「アボガドロ数(Avogadro number)」と呼ばれることもありますが、国際基準では「アボガドロ定数(Avogadro constant)」と呼ぶように決められています。

→「ムロツヨシさんって誰?」って人はコチラ【ムロツヨシ(google画像検索)】


人の名前です。
アメデオ・アボガドロ氏から名づけられました。
ただし、アボガドロ本人がアボガドロ定数を定義した訳ではありません。
元々は、ロシュミットという学者さんが導き出し、その後ペランという学者さんが実験を行い立証して「アボガドロ定数」と名付けました。
最初に考えた人がロシュミットなので、ドイツ語圏では
「ロシュミット数:Loschmidt-Konstante」
と呼ぶ人がいるそうです。
しかし「ロシュミット数」は、また別の意味があるので、混同しないようにしましょう。
ちなみに「アボガドロの法則」は、「アボガドロ定数」が生まれる前に、アボガドロ氏本人が仮説しています。
Q1. モルとは、●×1023個の粒子をひとまとめにした単位のこと。●には何が入る?→答え
Q2. この数は、何定数と呼ばれている?→答え
このことだけでも理解できていれば、計算問題も解きやすくなると思います😋
公式を丸暗記してその通りに解くだけなんて…つまらないですもんね。
「モル」の意味がわかっても、
「金1mol」なんて急に言われた所で、それがどのくらいなのかポンと思い浮かびませんよね。
なので、有名どころで1mol当たりの量をまとめてみました。
モル質量が小さい物から順に行きますね。
この指輪のダイヤモンド60個分で1モル
炭素でできているダイヤモンドは1グラム当たり「5カラット」です。
つまり、1molあたり12gで60カラット。
この指輪のダイヤモンドは1カラット(0.2g)なんですって。
ということは、これが60個分!
60個買占めたら8千万円近く行きますw
※加工代やリングの原価、デザイン代などにもお金はかかっているのでダイヤモンドだけでこの価格にはなりません
カレースプーン1杯+ティースプーン半分くらいで1モル
カレースプーンで15cc、ティースプーン5ccくらいなので。
ダイヤモンドを見た後に水を見たらショボイですねw

一円玉27枚分で1モル
一円玉はアルミニウムでつくられており、一枚1gなので。


ネイチャーメイドのカルシウムサプリメント133粒分で1モル
ネイチャーメイドのカルシウムサプリは一粒あたり0.3g入っているそうなので、サプリ133個あれば1molのカルシウムがゲットできます。
この商品は200粒入りなので1つ買えば手に入りますね。
ちなみに骨100gにはカルシウムが30~40%程度含まれています。


これは犬用のおやつの豚骨で、100g入っているそうです。なので、だいたいこのくらいでカルシウム1molがとれます。
牛乳の場合だと、100g当たりカルシウムが0.11g含まれています。(牛乳の成分のほとんどは水です。)
牛乳からカルシウム40gを摂るためには36,363gの牛乳が必要です。牛乳1Lあたり1030gなので、大きい牛乳パック35.3本分になります。


「食卓塩」の6割くらいで1モル
おなじみ赤いキャップの食卓塩は100g入りなので、塩1molでこれの6割くらい。
案外多いように感じます!(主観)

10円玉15枚分くらいで1モル
10円硬貨は95%が銅で出来ています。
1枚4.5g当たり銅は4.275g含まれているので、10円玉15枚くらいで銅1mol。


純銀のコーヒースプーン5本分くらいで1モル
このコーヒースプーンは純度95%の「純銀」であり、1本22gあるみたいです。
なので、ちょうどこの写真の5本のスプーンで1molくらいの銀になります。
このペアリングの、リング部分は銀の純度が92.5%で作られているらしいです。それでも「純銀」として扱ってOKなんですって。
シンプルでお洒落ですし、自分で簡単にサイズを調節することができるようです。
セール中でお得に買えるみたいなので、大好きな人とペアで1セットいかがでしょうか?
細いネックレスの鎖115本分くらいで1モル
白金は「プラチナ」と言った方が馴染みがあるかもしれません。
ネックレスの鎖の部分によく使われます。
このネックレスは99.9%プラチナで出来ており、重量は1.7gだそうです。
つまりこのネックレスから1molプラチナを集めようと思ったら115本購入することになります😊
うーん、ちょっとわかりにくいですかね。
コーヒースプーン10本分くらいで1モル、と言った方がわかりやすいでしょうか?
ちょっとゴツイ純金のネックレス20本分くらいで1モル
この純金のネックレスで10gだそうです。
なので、このネックレスが20本くらいで金1mol。
野球選手で、金のネックレスを付けている人がたまにいますけど、こういう感じの純金の物なんでしょうかね?🤔
純金の大判・小判見つけました♪
この大判は1枚100gなので、2枚で1molですね。
小判は1枚5gの小さいものなので、39枚で1molです。
小さい頃に「日本昔ばなし」を見ていたら、大判小判って憧れますよねw


さて、このおじいさんについてクイズです🌟
Q. 2500molの金は何gでしょう?
答え. 492,500g。
解説)金は1molあたり197gなので、2500×197=492,500。
つまり100gの大判4925枚とすると、
大判1枚170万円として計算すれば、
おじいさんは8,372,500,000円(83億7250万円)をゲットしたことになります😲
教科書では、「モルは鉛筆1ダースに例えるとわかりやすくなる」と説明されていませんか?
この「ダースの例え」は昔から使われています。それにも関わらず、モルを理解できない人が多いということは、例えが悪いという証拠です。
そもそも現代の人は鉛筆をダースで買いませんし、しかも鉛筆の大きさは限られています。原子は種類によって大きさが違うので、鉛筆に例えるのはナンセンスです。
それに鉛筆は他の物質とペアになったりすることはありませんから、原子が分子になった時、鉛筆を想像していた人はどうやってモルを数えたらいいのかわからなくなってしまいますよね。
モルなんて、一度理解してしまえばシンプルなのに、こんなにわからない人がいるということは、「ダースの例え」が悪いからなんだろうな…と思う今日この頃なのでした。
関連記事はコチラ
➜ サイトのもくじ【化学】
あえて「ダースの例え」を使わずに他のものに例えて説明します!😄
公式なしでも必ず理解できる!!
Contents
・モルとは?
・例えてみます
・具体的に見てみましょう!
炭素は1molで何g?
・モル質量は、原子量と同じ数になる
・「1023」「10-23」って何?
・教科書的な考え方
・6.02×1023個って結局何個?
・なんで6.02×1023という中途半端な数字なの?
アボガドロ定数の覚え方
・「アボガドロ」って何?🥑
・1モルってどのくらい?
・モルをダースに例えると混乱する件
・モルとは?
・例えてみます
・具体的に見てみましょう!
炭素は1molで何g?
・モル質量は、原子量と同じ数になる
・「1023」「10-23」って何?
・教科書的な考え方
・6.02×1023個って結局何個?
・なんで6.02×1023という中途半端な数字なの?
アボガドロ定数の覚え方
・「アボガドロ」って何?🥑
・1モルってどのくらい?
・モルをダースに例えると混乱する件
モルとは?
モルとは簡単に言うと、「物質の単位」です!
具体的には、6.02×1023個を1セットとした粒子の集まりのことを言います。(詳しい数字については後述します)

ワガハイの名はモルガナだけどな!(ペルソナ5より)
理解しやすくするために例えてみます
今、オリジナルの単位を一つ思いつきました💡
その単位を「モリ」とします。
そして、動物6組を1セットで「1モリ」とします。
例えば…

単独でいたい(他人とくっついていたくない)動物は、6匹で1モリとします。
群れたい(他人とくっついていたい)動物は、6グループで1モリとします。

同じ動物でも、単独でいたい時と群れたい時があります。
群れたい場合は、くっついた状態で1グループとなり、それが6グループで1モリとなります。
ここで一番重要となるのは、「×6」で「1モリ」としている点です。
ではクイズです🌟
Q. 体重2kgのニワトリが1モリいると何kgになりますか?
(答えは下にあります)
答え. 12kg。
解説)2kg×6羽なので。
Q. 体重2.6kgのうさぎと、体重0.2kgの鳩2羽の仲良しグループが1モリいると、全体で何kgになりますか?
※ヒント:うさぎ2.6kg+鳩0.2kg+鳩0.2kg=3.0kg→それが1モリいると?
答え. 18kg。
解説)うさぎと鳩のグループ3.0kg×6組となって18kg。
わからない時は紙にイラストを書いてみると理解できますよ😊
Q. 単独行動が好きな犬がたくさんいます。犬全体の重さをまとめて計ったところ、48kgありました。犬は何モリいますか?※犬は1匹4kgとする。
※ヒント:まず犬の数を出す。48kg÷4kg=12匹。→つまり何モリ?
答え. 2モリ。
解説)6で割ります。12匹÷6=2モリ

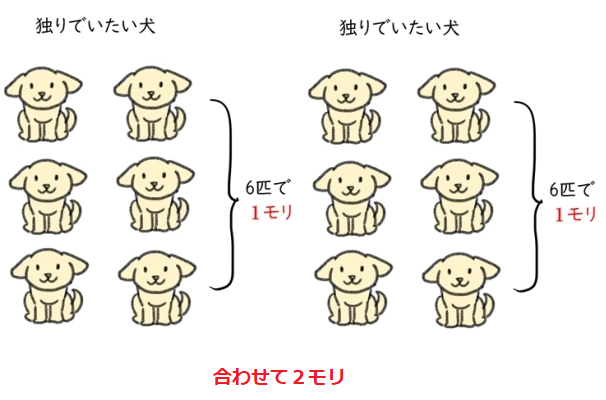
Q. 2匹で1組になりたい犬がたくさんいます。犬全体の重さをまとめて計ったところ、48kgありました。ペアの犬は何モリいますか?※犬は1匹4kgとする。
※ヒント:まず犬の数を出す。48kg÷4kg=12匹。今回はペアの犬なので…?
答え. 1モリ。
解説)2匹で1組なので、それが6つ=12匹で1モリ。

どうでしたでしょう?意外と単純な計算ではないでしょうか?
「モル」も同じような考え方になります!
上の説明で動物としていたものを「粒子」として考えます。
◆単独行動をしたい子は原子の粒
◆誰かと一緒にいないと落ち着かない子を分子の粒とします。

「原子」として単独行動する場合にもモルは使われますが、
「分子」として群れた状態でも「1粒の粒子」としてモルを使っていきます。
※「イオン結合」や「金属結合」では「分子」は出来ないものの、原子同士が結合して粒を形成しています。この場合も「1粒の粒子」としてモルを使っていきます。
具体的に見てみましょう!
(※今は「×1023」は無視してOKです。)
考え方は動物のモリと一緒です。
独りでいたい子は、6つ集まって1モル。
群れたい子達も、それが6つ集まってで1モル。
「1粒の重さ」つまり「質量」は体重のことなので、kgがgになっただけです。
炭素は1molで何g?
ダイヤモンドのもとである炭素(C)の質量(体重)は、
2.0×10-23gです。
これが1モル(6.02×1023個)あると…
(2.0×10-23)g×(6.02×1023)個 =12.04 g
よって、炭素は1モルあたり12gということになります。
※ここでも「×1023」は無視してOK。
このような、1モル当たりの物質の重さのことを「モル質量」と呼びます。
モル質量は「〇g/mol」というように表します。
なので、炭素のモル質量は12g/molです。

僕達の世界で言うと、「モリ体重」といったところでっしゃろか。
モル質量は、原子量と同じ数になる

モル質量は、原子量と同じ数になります。
周期表を見るとわかりますが、炭素の原子量は12です。
モル質量12g/molと同じですね。
すでに結合している物の場合は、原子を足した数がモル質量になります。
例えば塩化ナトリウム(NaCl)の場合、
Naの原子量は23、Clの原子量は35.5なので、
モル質量は58.5g/molとなります。
ではクイズです🌟
Q. 酸化アルミニウム(Al2O3)のモル質量を原子量から求める式を答えてください。
アルミニウムの原子量は27、酸素の原子量は16です。
答え. 27+27+16+16+16/もしくは(27×2)+(16×3)
よって酸化アルミニウムのモル質量は「102g/mol」になります。
「1023」「10-23」って何?
「1023」「10-23」が出てくるせいで、計算式が難しそうに見えてしまいますよね。
でも理解してしまえば楽勝!
◆「1023」は10の23乗。
「1にゼロが23個つきますよ」という意味です。
つまり、
1023
=100,000,000,000,000,000,000,000
=1000垓(がい)

世界の億万長者の総資産額にも出てこない桁ですね!😲
この数が出てくるタイミングは、「個数」が関係しているときです。
とにかく粒子は細かくてたくさんあるので、こうやって省略しなければやってられないのです。
◆「10-23」は10の-23乗。
「1の前にゼロが23個つきますよ」という意味です。
つまり、
10-23
=0.00000000000000000000001
=1000垓分の1
この数が出てくるタイミングは、「粒子の重さ」が関係しているときです。
とにかく粒子はサイズが小さく軽いので、こうやって省略しなければやってられないのです。
(1023)×(10-23)=1になる
「10×0.1=1」になるように、同じ数のゼロが前後についている数字をかけると1になります。なので、先にあった
(6.02×1023)個 ×(2.0×10-23)g=12.04 g
という計算式の青字の部分は相殺されるので消えてなくなります。
ではクイズです🌟
Q. 質量3.0×10-23gの水分子のモル質量は何gですか?
答え. 18g。
解説)質量3g×6.02個。
もしくは、原子量を知っていれば酸素の原子量16と水素の原子量1×2個を合わせて出してもOK。
Q. では、水10molには、水分子が何個含まれていますか?
答. 6.02×1024個
解説)水1molには水分子は6.02×1023個含まれているので、その10倍。
ゼロが1つ増えるので10の右上に付いている数が1増えます。
たまにこういう問題出ますけど、
もはや化学の問題ではなく数学の問題ですよね。
Q. では、CO2の質量は何gですか?(原子量:C=12、O=16)
ヒント:
①まずCO2のモル質量出します。
原子量=モル質量なので、
12+16+16=44で、44g/molであることがわかります。
②1molあたり44gということなので、CO2の重さは…?
答. 7.3×10-23g
解説)44÷6.02=7.3。→7.3×10-23g
※「23」の前につけるものが「+」なのか「-」なのか分からなくなった時は、イメージを思い出しましょう。
個数が関係してくるときはそれが大量にあるので「+」、粒子の重さが関係してくるときはそれの大きさがあまりにも軽いので「-」が付きます。
教科書的な考え方
モルを理解すれば、公式は必要ないことがわかりましたね。
でも先生によっては公式そのものをテストで聞いてくることもあるみたいなので、テンプレートの公式を貼っておきますね。

◆物質量〔mol〕:何molあるか?です。モルの数のことを物質量と言います。
◆物質の質量〔g〕:その物質の重さの事です。何モルあったとしても、全~部あわせた合計の重さです。
◆モル質量〔g/mol〕:1モル当たりの重さです。原子の合計の数と同じ数になります。
名前が紛らわしくてイラっと来ますよね。
この公式の存在が学生のモル嫌いを加速させている気がします。
→【まとめ】相対質量,原子量,〇の質量,物質量,モル質量,質量数,分子量,式量の違いをわかりやすく解説!
試しに当てはめてみましょう。
水の物質量1mol、水の質量18g、水のモル質量18g/mol◆水の物質量を求めたい時
❓mol=18g÷18g/mol
→1になりますね。
◆水の質量を求めたい時
1mol=❓g÷18g/mol
→1=❓/18
→両方に18をかけたら、答えは18になりますね。(この計算がわからない人は公式に触れない方がいいです。)
◆水のモル質量を求めたい時
1mol=18g÷❓
→1=18/❓
→18になりますね。
公式に矛盾がないことが確認できました。
では公式にあてはめてみようクイズです🌟
Q. 水が180gあります。物質量は何molですか?(水の原子量は18)
答. 10mol
解説)❓mol=180g÷18g/mol
Q. 2molのアルミニウムの質量は何gですか?(アルミニウムの原子量は27)
答. 54g
解説)2mol=❓÷27g/mol
※公式に当てはめる手間よりも普通に考えて2mol×27をしてしまった方が早い
Q. 0.5molあたり66.75gの塩化アルミニウムのモル質量は何mol/gですか?
答. 133.5mol/g
解説)0.5mol=66.75g÷❓
公式に当てはめようとすると急にややこしく感じる公式マジックにかからないように気をつけましょう😅
6.02×1023個って結局何個なの?
1molである「6.02×1023」は何個か?
ここまで見てきたら何となくわかりますね。
1023
=100,000,000,000,000,000,000,000
に
6.02をかけるので、
602,000,000,000,000,000,000,000 。
つまり、6020垓。
ろくせんにじゅうがいです。
ニワトリが6020垓いると考えると、ものすごい数に感じますね。
でも原子や分子はこれだけ集まって、ようやく1モルなのです。
※厳密には、今わかっている時点で6.022140857×1023 個
なんで6.02×1023という中途半端な数字なの?
~アボガドロ定数とは~
この数字を考えるにあたって重要なキーワードは、「粒子」と「原子量」です。
粒子は、1粒の物質の事ですね。原子量は、周期表の元素名の下に書いてあるアレです。持っている陽子と中性子を足した数です。
で、不思議なことに、
粒子が一定数集まると、どんな物質でも原子量(または原子が結合した合計)の数と同じ重さになることが学者さんの研究でわかりました。
その粒子の一定数が「6.02×1023」だったのです。この数を導き出した人、すごいです😊
そして、この不思議な数は「アボガドロ定数」(NA)と名付けられることになりました。
「アボガドロ数(Avogadro number)」と呼ばれることもありますが、国際基準では「アボガドロ定数(Avogadro constant)」と呼ぶように決められています。
アボガドロ定数の覚え方

→「ムロツヨシさんって誰?」って人はコチラ【ムロツヨシ(google画像検索)】
「アボガドロ」って何?🥑

なにそれ?食べられるの?
人の名前です。
アメデオ・アボガドロ氏から名づけられました。
ただし、アボガドロ本人がアボガドロ定数を定義した訳ではありません。
元々は、ロシュミットという学者さんが導き出し、その後ペランという学者さんが実験を行い立証して「アボガドロ定数」と名付けました。
最初に考えた人がロシュミットなので、ドイツ語圏では
「ロシュミット数:Loschmidt-Konstante」
と呼ぶ人がいるそうです。
しかし「ロシュミット数」は、また別の意味があるので、混同しないようにしましょう。
ちなみに「アボガドロの法則」は、「アボガドロ定数」が生まれる前に、アボガドロ氏本人が仮説しています。
確認クイズ
では、重要事項の確認クイズです。Q1. モルとは、●×1023個の粒子をひとまとめにした単位のこと。●には何が入る?→答え
Q2. この数は、何定数と呼ばれている?→答え
このことだけでも理解できていれば、計算問題も解きやすくなると思います😋
公式を丸暗記してその通りに解くだけなんて…つまらないですもんね。
1モルってどのくらい?
「モル」の意味がわかっても、
「金1mol」なんて急に言われた所で、それがどのくらいなのかポンと思い浮かびませんよね。
なので、有名どころで1mol当たりの量をまとめてみました。
モル質量が小さい物から順に行きますね。
炭素:12g
この指輪のダイヤモンド60個分で1モル
炭素でできているダイヤモンドは1グラム当たり「5カラット」です。
つまり、1molあたり12gで60カラット。
この指輪のダイヤモンドは1カラット(0.2g)なんですって。
ということは、これが60個分!
60個買占めたら8千万円近く行きますw
※加工代やリングの原価、デザイン代などにもお金はかかっているのでダイヤモンドだけでこの価格にはなりません
水:18g

カレースプーン1杯+ティースプーン半分くらいで1モル
カレースプーンで15cc、ティースプーン5ccくらいなので。
ダイヤモンドを見た後に水を見たらショボイですねw
アルミニウム:27g

一円玉27枚分で1モル
一円玉はアルミニウムでつくられており、一枚1gなので。
カルシウム:40g

ネイチャーメイドのカルシウムサプリメント133粒分で1モル
ネイチャーメイドのカルシウムサプリは一粒あたり0.3g入っているそうなので、サプリ133個あれば1molのカルシウムがゲットできます。
この商品は200粒入りなので1つ買えば手に入りますね。
ちなみに骨100gにはカルシウムが30~40%程度含まれています。

これは犬用のおやつの豚骨で、100g入っているそうです。なので、だいたいこのくらいでカルシウム1molがとれます。
牛乳の場合だと、100g当たりカルシウムが0.11g含まれています。(牛乳の成分のほとんどは水です。)
牛乳からカルシウム40gを摂るためには36,363gの牛乳が必要です。牛乳1Lあたり1030gなので、大きい牛乳パック35.3本分になります。
◆常温保存可能なかわいい牛乳3選(飲みきりサイズ)
塩:58g

「食卓塩」の6割くらいで1モル
おなじみ赤いキャップの食卓塩は100g入りなので、塩1molでこれの6割くらい。
案外多いように感じます!(主観)
銅:64g

10円玉15枚分くらいで1モル
10円硬貨は95%が銅で出来ています。
1枚4.5g当たり銅は4.275g含まれているので、10円玉15枚くらいで銅1mol。
銀:107g

純銀のコーヒースプーン5本分くらいで1モル
このコーヒースプーンは純度95%の「純銀」であり、1本22gあるみたいです。
なので、ちょうどこの写真の5本のスプーンで1molくらいの銀になります。
このペアリングの、リング部分は銀の純度が92.5%で作られているらしいです。それでも「純銀」として扱ってOKなんですって。
シンプルでお洒落ですし、自分で簡単にサイズを調節することができるようです。
セール中でお得に買えるみたいなので、大好きな人とペアで1セットいかがでしょうか?
白金(プラチナ):195g
細いネックレスの鎖115本分くらいで1モル
白金は「プラチナ」と言った方が馴染みがあるかもしれません。
ネックレスの鎖の部分によく使われます。
このネックレスは99.9%プラチナで出来ており、重量は1.7gだそうです。
つまりこのネックレスから1molプラチナを集めようと思ったら115本購入することになります😊
うーん、ちょっとわかりにくいですかね。
コーヒースプーン10本分くらいで1モル、と言った方がわかりやすいでしょうか?
金:197g
ちょっとゴツイ純金のネックレス20本分くらいで1モル
この純金のネックレスで10gだそうです。
なので、このネックレスが20本くらいで金1mol。
野球選手で、金のネックレスを付けている人がたまにいますけど、こういう感じの純金の物なんでしょうかね?🤔
純金の大判・小判見つけました♪
この大判は1枚100gなので、2枚で1molですね。
小判は1枚5gの小さいものなので、39枚で1molです。
小さい頃に「日本昔ばなし」を見ていたら、大判小判って憧れますよねw

おむすびが転がった先でネズミと仲良くなったら「うちでのこづち」をもらったぞ。
これを使ったら2500mol相当の純金の大判小判がザックザックと出てきたわい。
これを使ったら2500mol相当の純金の大判小判がザックザックと出てきたわい。
さて、このおじいさんについてクイズです🌟
Q. 2500molの金は何gでしょう?
答え. 492,500g。
解説)金は1molあたり197gなので、2500×197=492,500。
つまり100gの大判4925枚とすると、
大判1枚170万円として計算すれば、
おじいさんは8,372,500,000円(83億7250万円)をゲットしたことになります😲
おまけ:モルをダースに例えると混乱する件
教科書では、「モルは鉛筆1ダースに例えるとわかりやすくなる」と説明されていませんか?
この「ダースの例え」は昔から使われています。それにも関わらず、モルを理解できない人が多いということは、例えが悪いという証拠です。
そもそも現代の人は鉛筆をダースで買いませんし、しかも鉛筆の大きさは限られています。原子は種類によって大きさが違うので、鉛筆に例えるのはナンセンスです。
それに鉛筆は他の物質とペアになったりすることはありませんから、原子が分子になった時、鉛筆を想像していた人はどうやってモルを数えたらいいのかわからなくなってしまいますよね。
モルなんて、一度理解してしまえばシンプルなのに、こんなにわからない人がいるということは、「ダースの例え」が悪いからなんだろうな…と思う今日この頃なのでした。
関連記事はコチラ
➜ サイトのもくじ【化学】