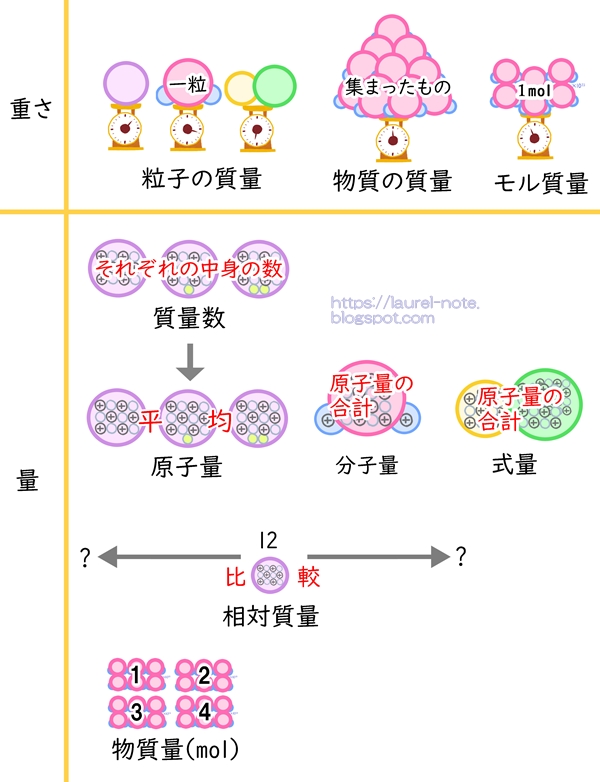
【まとめ】相対質量,物質量,原子量,〇の質量,モル質量,質量数,分子量,式量の違いをわかりやすく解説!
訳が分からない人~~(^O^)/
違いをまとめました!
化学が苦手な人向け!


はじめに:
重量とは、地球の引力によって引っ張られる力です。単位はN(ニュートン)。
質量とは、地球の引力に関係なく、物体の動かしにくさのことを言います。単位はkgやgです。
本来の意味では、「重さ」という言葉は「重量(N)」のことを指しますが、
一般的には、「質量(kg、g)」として使われているので
このページでは、わかりやすくするために
「質量」のことを「重さ」として表現していきます。
「〇〇1個の質量」と書かれることもあります。
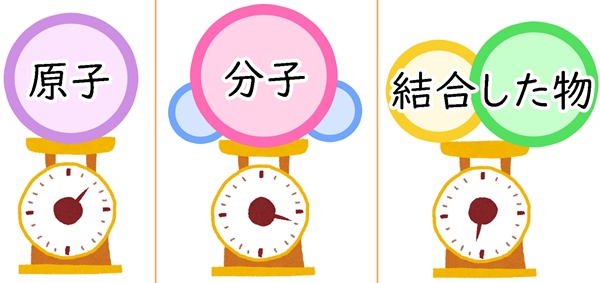
◆例
・炭素原子:2.0×10-23g
・水分子:3.0×10-23g
・アルミニウム:4.5×10-23g
・塩化ナトリウム:9.7×10-23g
原子はもちろんですが、分子も、塩化ナトリウムなどのような弱い力で結合した物も、一つの粒として考えられます。
粒の重さは、原子に含まれる陽子、中性子、電子の重さよって決まるので、この数字は基本変わりません。
・炭素原子:19.926×10-24g
などと、小数点をずらして記載されることもあります。

◆例
・炭素原子:「黒鉛12g」
「ダイヤモンド1g」
・水分子:「コップに入った水180g」
・アルミニウム:「アルミニウム30g」
・塩化ナトリウム:「塩20g」
物質の質量は、「今そこにある物質の重さは何gあるか」という意味です。
なのでいつも数は違います。
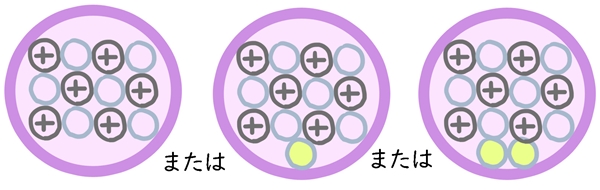
◆例(単位なし)
・水素:1または2または3
・炭素:12または13または14
・酸素:16または17または18
・塩素:35または37
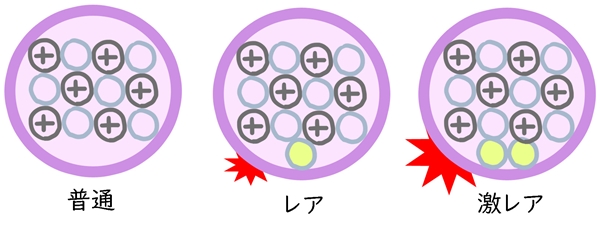
このような、同じ原子でも質量数が違うもののことを同位体(アイソトープ)と呼びます。
原子の種類によって同位体のレア度が変わります。
・水素の質量数が2の場合:2H
・水素の質量数が3の場合:3H
・炭素の質量数が12の場合:12C
・炭素の質量数が13の場合:13C
・炭素の質量数が14の場合:14C
→自然に存在する水素のほとんどは1H
・2H:0.0115%
→つまりだいたい10000分の1の確率。
チョコボールの金のエンゼルが出る確率がこのくらいらしいです。
・3H:ごく微量
・12C:98.93%
・13C:1.07%
・14C:ごく微量
・17O:99.757%
・17O:0.038%
・17O:0.205%
・35Cl:75.76%
・35Cl:24.24%
「ごく微量」とか…伝説のポケモンが卵を産んでそこから色違いが生まれるようなものですね😝
◆例(単位なし)
・水素原子:1.008
・炭素原子:12.01
・酸素原子:16.00
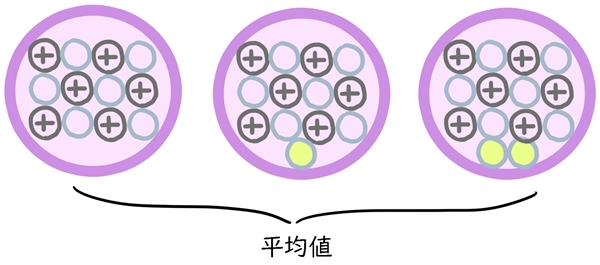
周期表の下に書いてある数字は原子量です。
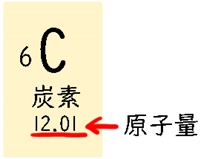
「質量数の説明」では、「原子には「同位体」があり、それによって中性子の数が違うこと」を説明しました。
原子量は、その原子の同位体の質量数の平均値です。
◆例(単位なし)
・質量数1の水素:1.0 (1.0078)
・質量数12の炭素:12
・質量数16の炭素:16.0 (15.995)
・質量数23のナトリウム:23.0 (22.990)
「ぶっちゃけ相対質量として比べる必要なくない?別にこの数字だったら質量数や原子量で比べられるよね?」と思いますが、テストに出やすいので意味だけは覚えておきましょう🙊
炭素の方が、いろいろな物質と結合していて計算しやすいからのようです。
ちなみに「12」が選ばれたのは炭素の中で一番多いからです。
◆例(単位なし)
・水分子(H2O):18(Hの原子量は1、Oの原子量は16なので、1+1+16)
・メタン分子(CH4):16(Cの原子量は12なので、12+1+1+1+1)
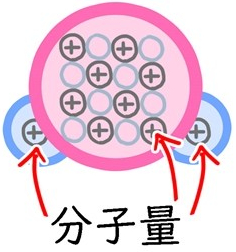
結合している原子量をすべて足した数のこと。
◆例(単位なし)
・塩化ナトリウム(NaCl):58.5(Naの原子量は23、Clの原子量は35.5なので足す)
数の数え方は分子量と同じで、その結合に含まれる原子の数を足すだけです
なぜ分子量と区別される?
分子は「決まった原子が決まった数だけ結合したもの」でしたが、
自然界には「結合している数や種類が決まっていないもの」も存在します。
それは「イオン結合」や「金属結合」という弱い力で、たくさんの原子が結合しているものです。
はっきりとした数が出せないので、分子量と区別されています。
1モル当たりの重さのこと。
◆例
・炭素原子:12g/mol
・水分子:18g/mol
・アルミニウム:27g/mol
・塩化ナトリウム:58.5g/mol
原子量/分子量/式量と同じ数になります。
単位を忘れずに。
→詳しくは【モル質量】
◆例
・炭素原子:1mol
・水分子:0.5mol
・アルミニウム:4mol
・塩化ナトリウム:10mol
物質量は、「今そこにある物質は何molあるか」という意味です。
なのでいつも数は違います。
「物質量」は、「物・質量」ではなく「物質・量」。
「物質の量」のことであって、「質量(g)」のことを聞いている訳ではないのでお間違えなく💡
関連記事はコチラ
➜ サイトのもくじ【化学】
違いをまとめました!
化学が苦手な人向け!
🔶相対質量,原子量,物質量,分子量,〇の質量,式量,モル質量
Contents
・はじめに:重量と質量の違い
・粒子の質量とは?
・物質の質量とは?
・質量数とは?
・原子量とは?
・原子の相対質量とは?
・分子量とは?
・式量とは?
・モル質量とは?
・物質量とは?
・まとめ
・はじめに:重量と質量の違い
・粒子の質量とは?
・物質の質量とは?
・質量数とは?
・原子量とは?
・原子の相対質量とは?
・分子量とは?
・式量とは?
・モル質量とは?
・物質量とは?
・まとめ

リョウのすべてを知りたくて…。
(詳細を知りたい人は画像をクリック)
(詳細を知りたい人は画像をクリック)
はじめに:
重量と質量の違い
重量とは、地球の引力によって引っ張られる力です。単位はN(ニュートン)。質量とは、地球の引力に関係なく、物体の動かしにくさのことを言います。単位はkgやgです。
本来の意味では、「重さ」という言葉は「重量(N)」のことを指しますが、
一般的には、「質量(kg、g)」として使われているので
このページでは、わかりやすくするために
「質量」のことを「重さ」として表現していきます。
粒子の質量とは?
粒子一粒の重さのこと。「〇〇1個の質量」と書かれることもあります。

◆例
・炭素原子:2.0×10-23g
・水分子:3.0×10-23g
・アルミニウム:4.5×10-23g
・塩化ナトリウム:9.7×10-23g
原子はもちろんですが、分子も、塩化ナトリウムなどのような弱い力で結合した物も、一つの粒として考えられます。
粒の重さは、原子に含まれる陽子、中性子、電子の重さよって決まるので、この数字は基本変わりません。
・炭素原子:19.926×10-24g
などと、小数点をずらして記載されることもあります。
物質の質量とは?
物質の重さのこと。
◆例
・炭素原子:「黒鉛12g」
「ダイヤモンド1g」
・水分子:「コップに入った水180g」
・アルミニウム:「アルミニウム30g」
・塩化ナトリウム:「塩20g」
物質の質量は、「今そこにある物質の重さは何gあるか」という意味です。
なのでいつも数は違います。
質量数とは?
原子が持っている陽子と中性子の数のこと。
◆例(単位なし)
・水素:1または2または3
・炭素:12または13または14
・酸素:16または17または18
・塩素:35または37
なぜ数が違う質量数が存在するの?
基本的には、原子が持っている中性子は陽子と同じ数になるのですが、たまに中性子の数が多いことがあります。
このような、同じ原子でも質量数が違うもののことを同位体(アイソトープ)と呼びます。
原子の種類によって同位体のレア度が変わります。
同位体の書き方
・水素の質量数が1の場合:1H・水素の質量数が2の場合:2H
・水素の質量数が3の場合:3H
・炭素の質量数が12の場合:12C
・炭素の質量数が13の場合:13C
・炭素の質量数が14の場合:14C
存在比
・1H:99.9885%→自然に存在する水素のほとんどは1H
・2H:0.0115%
→つまりだいたい10000分の1の確率。
チョコボールの金のエンゼルが出る確率がこのくらいらしいです。
・3H:ごく微量
・12C:98.93%
・13C:1.07%
・14C:ごく微量
・17O:99.757%
・17O:0.038%
・17O:0.205%
・35Cl:75.76%
・35Cl:24.24%
「ごく微量」とか…伝説のポケモンが卵を産んでそこから色違いが生まれるようなものですね😝
原子量とは?
自然に存在する陽子と中性子を足した数の平均値のこと。
◆例(単位なし)
・水素原子:1.008
・炭素原子:12.01
・酸素原子:16.00
周期表の下に書いてある数字は原子量です。

「質量数の説明」では、「原子には「同位体」があり、それによって中性子の数が違うこと」を説明しました。
原子量は、その原子の同位体の質量数の平均値です。
原子の相対質量とは?
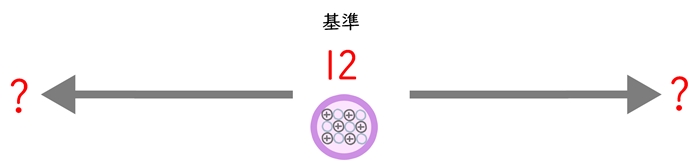
「質量数が12の炭素」を基準として、それと比べた数のこと。
◆例(単位なし)
・質量数1の水素:1.0 (1.0078)
・質量数12の炭素:12
・質量数16の炭素:16.0 (15.995)
・質量数23のナトリウム:23.0 (22.990)
「ぶっちゃけ相対質量として比べる必要なくない?別にこの数字だったら質量数や原子量で比べられるよね?」と思いますが、テストに出やすいので意味だけは覚えておきましょう🙊
相対とは?
「他のものと比べて」という意味があります。なぜ12Cが選ばれた?
元々の基準は「1H」だったらしいのですが、科学者さんたちの都合で変更されました。炭素の方が、いろいろな物質と結合していて計算しやすいからのようです。
ちなみに「12」が選ばれたのは炭素の中で一番多いからです。
分子量とは?
分子に含まれる原子量をすべて足した数のこと。
◆例(単位なし)
・水分子(H2O):18(Hの原子量は1、Oの原子量は16なので、1+1+16)
・メタン分子(CH4):16(Cの原子量は12なので、12+1+1+1+1)
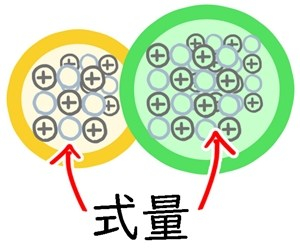
式量とは?
結合している原子量をすべて足した数のこと。

◆例(単位なし)
・塩化ナトリウム(NaCl):58.5(Naの原子量は23、Clの原子量は35.5なので足す)
数の数え方は分子量と同じで、その結合に含まれる原子の数を足すだけです
なぜ分子量と区別される?
分子は「決まった原子が決まった数だけ結合したもの」でしたが、自然界には「結合している数や種類が決まっていないもの」も存在します。
それは「イオン結合」や「金属結合」という弱い力で、たくさんの原子が結合しているものです。
はっきりとした数が出せないので、分子量と区別されています。
モル質量とは?
1モル当たりの重さのこと。

◆例
・炭素原子:12g/mol
・水分子:18g/mol
・アルミニウム:27g/mol
・塩化ナトリウム:58.5g/mol
原子量/分子量/式量と同じ数になります。
単位を忘れずに。
→詳しくは【モル質量】
物質量とは?
何モルあるかです。
◆例
・炭素原子:1mol
・水分子:0.5mol
・アルミニウム:4mol
・塩化ナトリウム:10mol
物質量は、「今そこにある物質は何molあるか」という意味です。
なのでいつも数は違います。
「物質量」は、「物・質量」ではなく「物質・量」。
「物質の量」のことであって、「質量(g)」のことを聞いている訳ではないのでお間違えなく💡
まとめ

関連記事はコチラ
➜ サイトのもくじ【化学】
