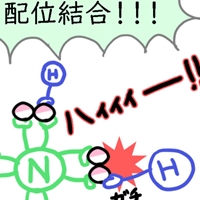
【化学嫌いさんへ】共有結合とは?わかりやすく説明♪
共有結合って何だっけ?!
ここなら、化学が超苦手な人でも理解できますよ♪


中学では、「原子には手がついている」「手の数によって結合する数が違う」と習いました。
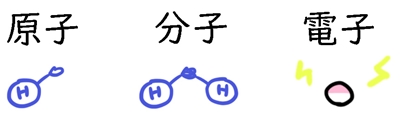
原子とは、水素原子(H)や酸素原子(O)など、単体でいる物質のことです。
分子とは、水素分子(H2)、酸素分子(O2)、水(H2O)など、結合して1つの物質になっているもののことです。
どっちがどっちなのかわからなくなった時は、原子は「物質の原点」、分子は「分解できるもの」であると思い出しましょう。
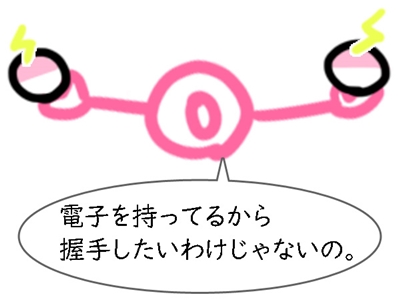
電子は、分子の回りに漂っている電気です。中に電気ポケモンが入ってると思ったら楽しくなりますよ。
で、この「手」というのは、詳しく説明すると電子を持っている手のことなんです。
例えば酸素の場合、中学校では「手が2つ」と習いましたが、見えていない手も表すと、こんな感じになります。
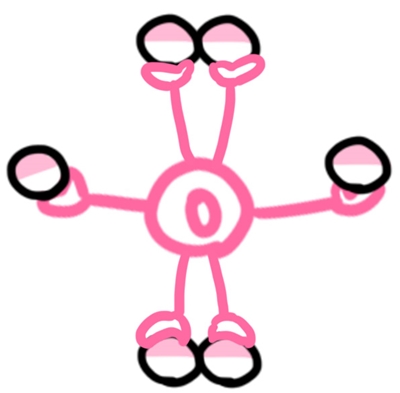
理科の先生が説明していた「手」と言うのは、「隣り合っている電子を持っていない手」ということだったんですね。
電子は、2つ隣同士になると安定します。逆に、1人ぼっちだと不安定になります。
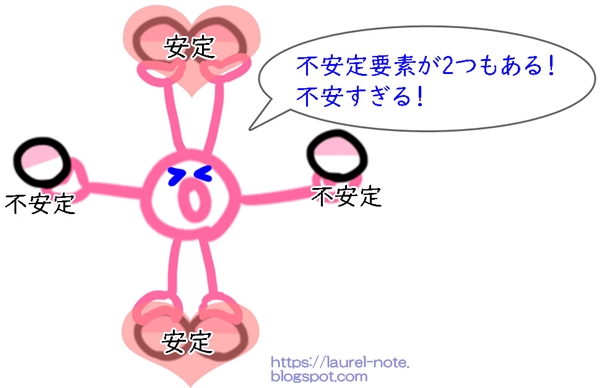
不安定要素を持っている原子はどうにか安定しようとするので、近くにいる「電子を一つしか持っていない誰かの手」を探してシェアしようとします。
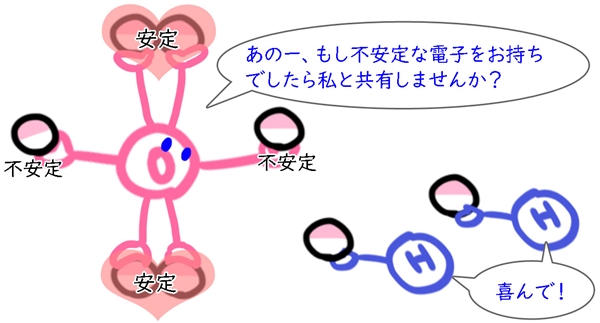
近くにいる「電子を一つしか持っていない誰かの手」も、安定したいので、見つけた相手と電子を共有します。
それが共有結合です。
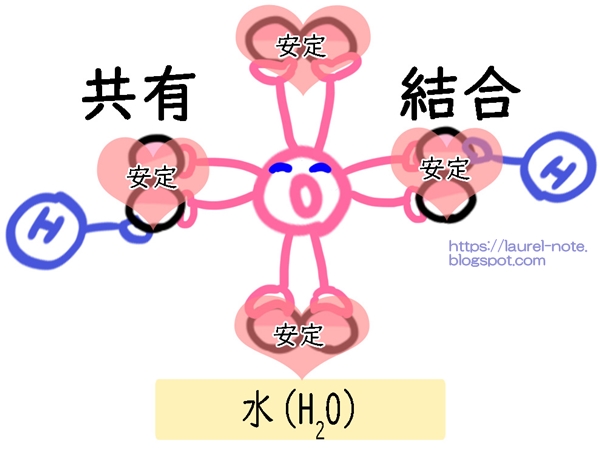
酸素(O)と水素(H)(H)が共有結合して、水(H2O)ができましたね。
不安定な手がたくさんある場合、たくさんの不安定な原子を呼ぶことになります。
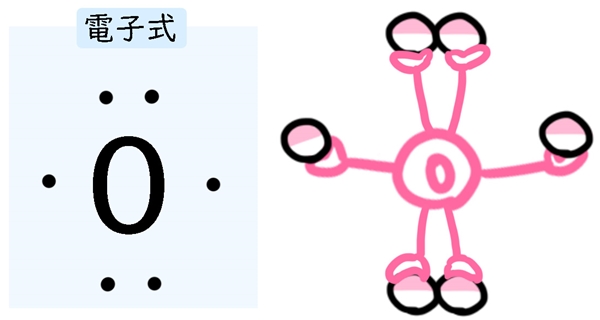
原子の元素記号の周りに、点をつけて外側の電子の数を現したものを電子式と言います。
原子が持っている電子の数は決まっています。
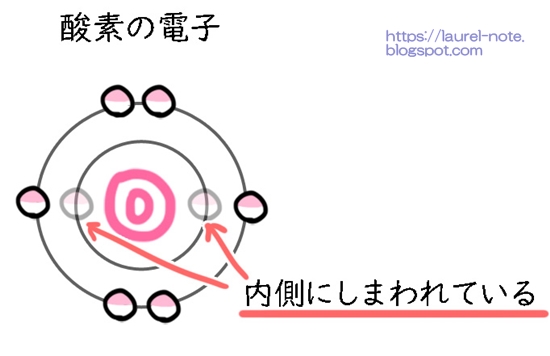
そして電子の数が多いと、それをコンパクトにするため二重にも三重にも電子を重ねることになります。卵の殻のようになっているので、「電子殻(でんしかく)」と言います。
1番内側は2個の電子、2番目は8個の電子、3番目は18個の電子、4番目は32個の電子の電子を配置することができます。
で、その1番外側の電子が何個あるか、というのが電子式で書かれる点となります。
例えば酸素が持っている電子の本当の数は8個です。電子殻によって2個収納されているので、外側の電子の数は6個になります。

点が隣り合っている、安定している電子同士を「電子対」、
1つしかない不安定な電子を「不対電子対」と言います。

中学で習った「手の数」の事を、化学用語で「原子価」と言います。
関連記事はコチラ
➜ サイトのもくじ【化学】
ここなら、化学が超苦手な人でも理解できますよ♪
🔶共有結合とは?

中学のおさらい

中学では、「原子には手がついている」「手の数によって結合する数が違う」と習いました。
原子と分子と電子の違い

原子とは、水素原子(H)や酸素原子(O)など、単体でいる物質のことです。
分子とは、水素分子(H2)、酸素分子(O2)、水(H2O)など、結合して1つの物質になっているもののことです。
どっちがどっちなのかわからなくなった時は、原子は「物質の原点」、分子は「分解できるもの」であると思い出しましょう。
電子は、分子の回りに漂っている電気です。中に電気ポケモンが入ってると思ったら楽しくなりますよ。
で、この「手」というのは、詳しく説明すると電子を持っている手のことなんです。

見えない手
実は、原子が持っている手の数は、見えていないものもあります。例えば酸素の場合、中学校では「手が2つ」と習いましたが、見えていない手も表すと、こんな感じになります。

理科の先生が説明していた「手」と言うのは、「隣り合っている電子を持っていない手」ということだったんですね。
電子は、2つ隣同士になると安定します。逆に、1人ぼっちだと不安定になります。

不安定要素を持っている原子はどうにか安定しようとするので、近くにいる「電子を一つしか持っていない誰かの手」を探してシェアしようとします。

近くにいる「電子を一つしか持っていない誰かの手」も、安定したいので、見つけた相手と電子を共有します。
それが共有結合です。

酸素(O)と水素(H)(H)が共有結合して、水(H2O)ができましたね。
不安定な手がたくさんある場合、たくさんの不安定な原子を呼ぶことになります。
電子式とは?

原子の元素記号の周りに、点をつけて外側の電子の数を現したものを電子式と言います。
「外側の」とは?

原子が持っている電子の数は決まっています。
そして電子の数が多いと、それをコンパクトにするため二重にも三重にも電子を重ねることになります。卵の殻のようになっているので、「電子殻(でんしかく)」と言います。
1番内側は2個の電子、2番目は8個の電子、3番目は18個の電子、4番目は32個の電子の電子を配置することができます。
で、その1番外側の電子が何個あるか、というのが電子式で書かれる点となります。
例えば酸素が持っている電子の本当の数は8個です。電子殻によって2個収納されているので、外側の電子の数は6個になります。
電子対と不対電子対

点が隣り合っている、安定している電子同士を「電子対」、
1つしかない不安定な電子を「不対電子対」と言います。
原子価とは?

中学で習った「手の数」の事を、化学用語で「原子価」と言います。
関連記事はコチラ
➜ サイトのもくじ【化学】