【マンガ】配位結合とは?わかりやすく説明!化学嫌いさんへ
配位結合って何?
共有結合と配位結合の違いは?
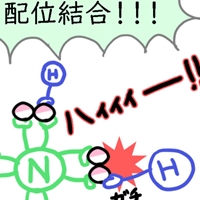
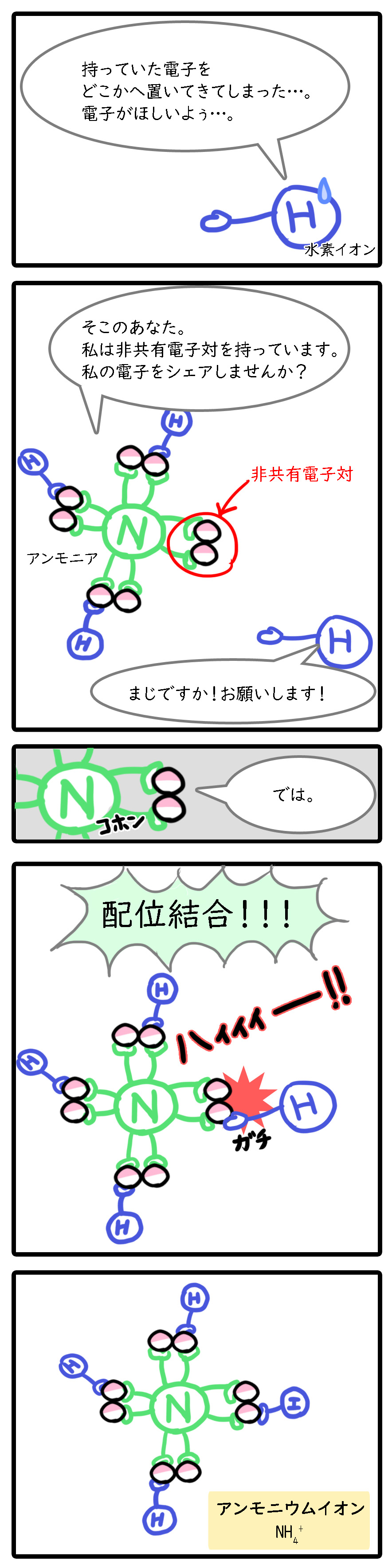
まずはこちらのマンガをご覧ください。
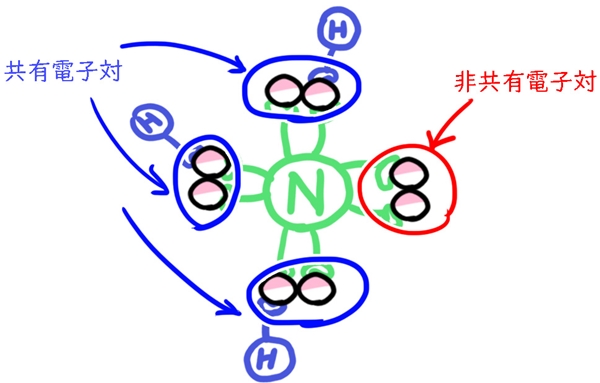
多くの原子は2つで一組のペアになる「電子対」を持っています。
「共有結合」により、他の原子と電子を共有している電子対を「共有電子対」といいます。
一方で、他の原子と共有していない電子対を「非共有電子対」と言います。
→詳しくは【共有結合とは?】
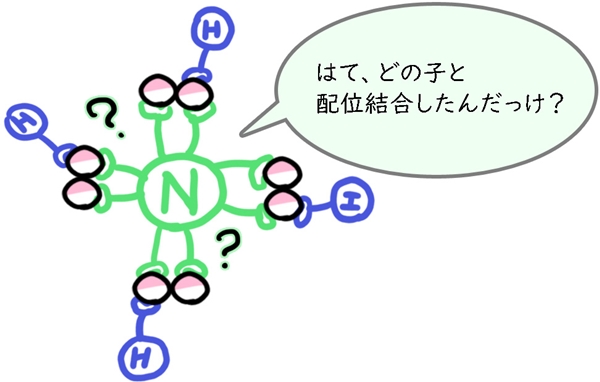
一度配位結合してしまえば、どこが配位結合なのかわからなくなります。
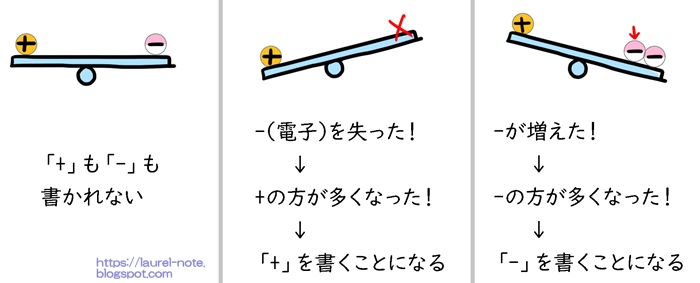
H(水素)が電子をなくすとH+(水素イオン)になります。
本来、原子は普通の状態では+(陽イオン)と-(陰イオン:電子)のバランスが保たれています。バランスが取れている時は、「+」も「-」も書かれません。
水素が電子(-)をなくすと、-を失って+が残ることになります。
その残ったものを書き表しているのです。
+が付くと「イオン」と言う呼び方が加わります。
ちなみに電子が増えて「-」が付くこと「~化物イオン」と言う呼び方になります。例えばClに電子が1つ付いて-が多くなった場合は、「塩化物イオン(Cl-)」になります。
つまり、上のNH4+に+が付いている理由は、元々電子をなくして「+」が付いていた水素がアンモニア(NH3)にそのままついたので、電子が1つ分少ない状態が保持され「+」が書かれているのです。
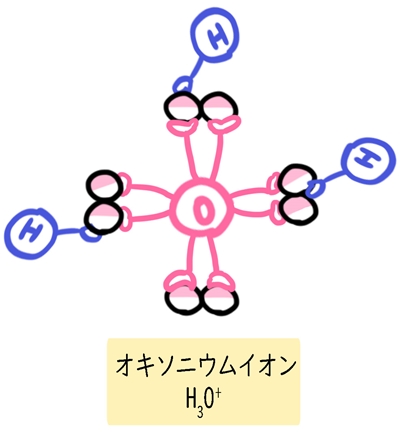
オキソニウムイオンは、水分子(H2O)に水素が1つ増えたものです。
なので、アンモニウムイオンと同じように、不対電子を水素イオンとシェアします。
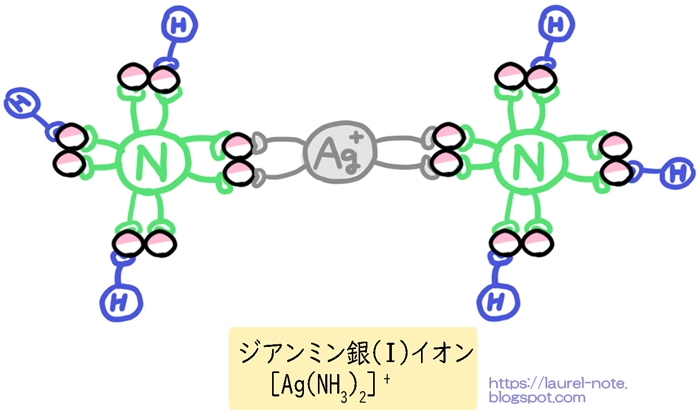
このように、金属イオンを中心として非共有電子対をもつ分子などが配位結合したイオンを錯イオン(さくいおん)と言います。
金属イオンに配位結合するものを配位子と呼びます。
配位子の数を配位数と言います。
つまり、ジアンミン銀(Ⅰ)イオンの配位子はアンモニア(NH3)、配位数は2ですね。
ジ=2個の
アンミン=アンモニアのこと
銀(Ⅰ)=1価の銀
イオン=錯イオンが+(陽イオン)
同じような考え方で、他の錯イオンの名前が付けられます。
数
3個=トリ 4個=テトラ 6個=ヘキサ
配位子
H2O=アクア CN-=シアニド OH-=ヒドロキシド Cl-=クロリド S2O32-=チオスルファト
酸化数
2価=(Ⅱ) 3価=(Ⅲ)
イオン
-(陰イオン)=~酸イオン
関連記事はコチラ
➜ サイトのもくじ【化学】
共有結合と配位結合の違いは?
🔶配位結合

アンモニウムイオン(NH4+)のでき方
まずはこちらのマンガをご覧ください。

配位結合(はいいけつごう)とは?
簡単に言うと、非共有電子対を原子とシェアする共有結合のことです。非共有電子対とは?

多くの原子は2つで一組のペアになる「電子対」を持っています。
「共有結合」により、他の原子と電子を共有している電子対を「共有電子対」といいます。
一方で、他の原子と共有していない電子対を「非共有電子対」と言います。
共有結合とは?
他の原子と電子を共有する結合です。→詳しくは【共有結合とは?】
ちなみに
一度配位結合してしまえば、どこが配位結合なのかわからなくなります。

◆なんで「+」、「イオン」がつくの?

H(水素)が電子をなくすとH+(水素イオン)になります。
本来、原子は普通の状態では+(陽イオン)と-(陰イオン:電子)のバランスが保たれています。バランスが取れている時は、「+」も「-」も書かれません。
水素が電子(-)をなくすと、-を失って+が残ることになります。
その残ったものを書き表しているのです。
+が付くと「イオン」と言う呼び方が加わります。
ちなみに電子が増えて「-」が付くこと「~化物イオン」と言う呼び方になります。例えばClに電子が1つ付いて-が多くなった場合は、「塩化物イオン(Cl-)」になります。
つまり、上のNH4+に+が付いている理由は、元々電子をなくして「+」が付いていた水素がアンモニア(NH3)にそのままついたので、電子が1つ分少ない状態が保持され「+」が書かれているのです。
オキソニウムイオン(H3O+)のでき方

オキソニウムイオンは、水分子(H2O)に水素が1つ増えたものです。
なので、アンモニウムイオンと同じように、不対電子を水素イオンとシェアします。
錯イオン
水分子やアンモニア分子は、水素だけではなく銅や銀などの金属イオンなどとも配位結合することがあります。
このように、金属イオンを中心として非共有電子対をもつ分子などが配位結合したイオンを錯イオン(さくいおん)と言います。
配位子
金属イオンに配位結合するものを配位子と呼びます。
配位数
配位子の数を配位数と言います。
つまり、ジアンミン銀(Ⅰ)イオンの配位子はアンモニア(NH3)、配位数は2ですね。
ジアンミン銀(Ⅰ)イオンの名前の由来
ジ=2個の
アンミン=アンモニアのこと
銀(Ⅰ)=1価の銀
イオン=錯イオンが+(陽イオン)
同じような考え方で、他の錯イオンの名前が付けられます。
数
3個=トリ 4個=テトラ 6個=ヘキサ
配位子
H2O=アクア CN-=シアニド OH-=ヒドロキシド Cl-=クロリド S2O32-=チオスルファト
酸化数
2価=(Ⅱ) 3価=(Ⅲ)
イオン
-(陰イオン)=~酸イオン
関連記事はコチラ
➜ サイトのもくじ【化学】

