なぜ「イオン」が付くの?
HClの場合
HClは、「H」が「Cl」に繋がった状態で安定しています。
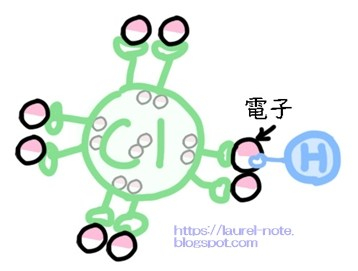
本来、
・Clは、持っている陽子(+)の数が「17」、電子(-)の数も「17」です。
・Hは、持っている陽子(+)の数が「1」、電子(-)の数も「1」です。
この二つが合体することにより、HClは合計で18個の陽子(+)と電子(-)を持っていることになります。
※Clは内側に10個の電子を隠し持っていて、外側に8個の電子を出しています。
外側の電子のうちの1つを、Hと共有しています。
ある時、HClが分離して、HとClに別れたとしましょう。
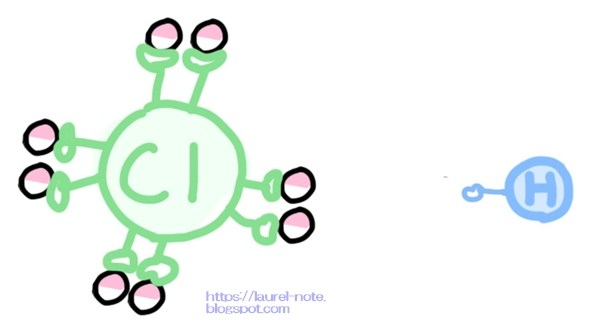
本来、Clが持っているはずの電子(-)は「17」のはずなのに、
水素は電子を残して離れて行ってしまいます。
なぜかと言うと、Clは電子(-)を「18」個持っている状態が最も安定するからです。(電子が偶数になる方が安定するのです)
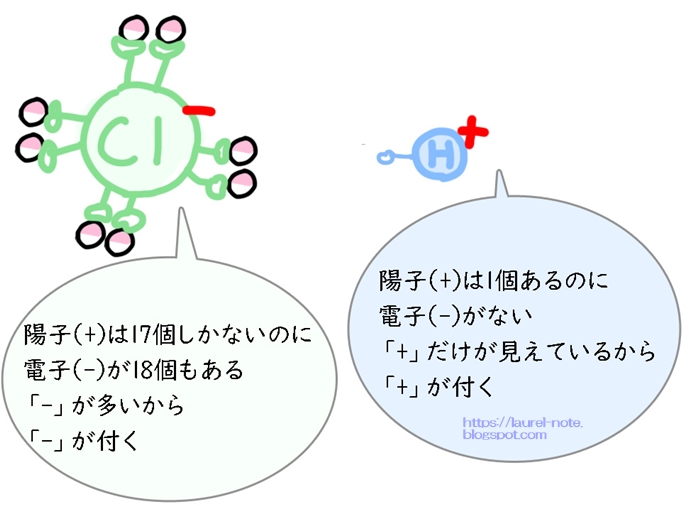
ここにあるClは今、電子(-)を18個持っていますが、
陽子(+)は変わらず17のままなので「-」が1つ余分になります。
「-」が1つ余分になると、Clの横には「-」が付きます。(ちなみに「-」が2つ余分な場合は「-2」が付きます。)
離れて行った水素は、本来電子(-)を1つ持っているはずですが持っていません。
そして陽子(+)は変わらず1のままです。
つまり、「+」が多い状態なので、Hの横に「+」が付くことになります。
物質の横に「+」や「-」がついたものを読み上げる時は、「イオン」と言います。
NAD+とH+の場合
電子伝達系で、電子を2個手放しています。
つまり、安定した状態からNADもHも1つずつ電子を失っているので、それぞれに「+」が付きます。
関連記事はコチラ
➜ サイトのもくじ【化学】

